トレミキシン®
製品コンセプト
トレミキシン®は、患者血液中のエンドトキシンを主とする病因物質を選択的に吸着除去する血液浄化器(カラム)です。内部には、ポリミキシンB固定化繊維をロール状に巻きつけた吸着体を有します。ポリミキシンBは、エンドトキシンと高い親和性を有する抗生物質ですが、腎障害、神経障害などの副作用があるため、大量に静脈内に投与することはできません。トレミキシン®では、ポリミキシンBを固定化した繊維により、血中エンドトキシンを選択的に吸着除去します。
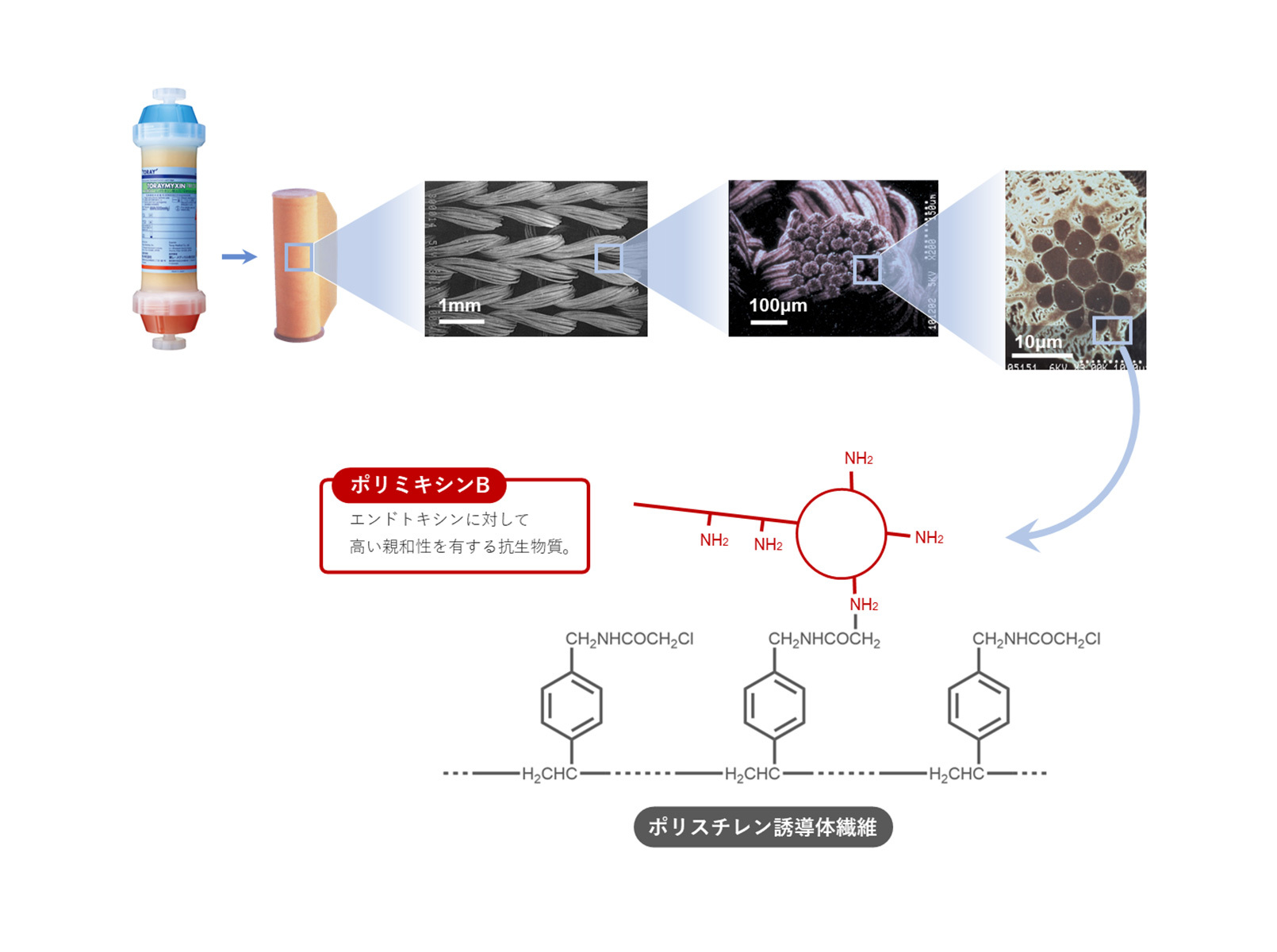
開発の経緯
1982年に滋賀医科大学外科学第一講座からの提案を受け、東レ繊維研究所との共同でトレミキシン®の開発研究が開始されました。1989年から多施設治験を実施して血中エンドトキシンの低下、循環動態改善などの臨床効果が確認され、1993年10月に製造承認を取得しました。翌1994年7月に保険収載され、8月から販売を開始しました。
海外では、1998年に欧州における基準に適合したことを示すCEマーキングを取得し、2001年からイタリアでの販売が開始されました。現在では、欧州、アジア、中東など世界10カ国以上で販売されています。
製品仕様

| 販売名 | トレミキシン® |
|---|---|
| 一般的名称 | エンドトキシン除去向け吸着型血液浄化用浄化器 |
| 承認番号 | 20500BZZ00926000 |
| クラス分類 | 高度管理医療機器(クラスⅢ) |
| 特定保険医療材料 | Ⅱ 047吸着式血液浄化用浄化器 (エンドトキシン除去用) |
| 製造販売元 | 東レ株式会社 |
| 販売元 | 東レ・メディカル株式会社 |
型番・仕様等
保険適用条件
エンドトキシン選択除去用吸着式血液浄化法の保険適用条件(対象患者)は、以下の通りです。
J041 吸着式血液浄化法
-
エンドトキシン選択除去用吸着式血液浄化法において、 18歳以上の患者にあっては、次のいずれにも該当する患者に対して行った場合に、「J041」吸着式血液浄化法により算定する。
-
ア.エンドトキシン血症が強く疑われる状態であり、次のいずれかの項目に該当するもの。なお、診療報酬明細書の摘要欄に①から③までのいずれかの要件を満たす医学的根拠について記載すること。
- ①細菌感染症を疑ってから当該治療が終了するまでに、エンドトキシン選択除去用吸着式血液浄化法の開始前までに行った「D018」細菌培養同定検査の「3」血液又は穿刺液血液(血液に限る。)において、グラム陰性桿菌の陽性が確認されている場合。
- ②細菌感染症を疑ってから当該治療が終了するまでに、他の保険医療機関においてグラム陰性桿菌の感染が疑われ抗菌薬投与が行われていたことが証明されている患者であって、当該医療機関において初回に実施した「D018」細菌培養同定検査の「3」血液又は穿刺液血液(血液に限る。)が陰性である場合。
- ③細菌感染症を疑ってから当該治療が終了するまでに、当該医療機関において初回に実施した「D018」細菌培養同定検査の「3」血液又は穿刺液血液(血液に限る。)が陰性であるものの、グラム陰性桿菌による敗血症性ショックであることが「D018」細菌培養同定検査の「3」血液又は穿刺液血液(血液に限る。)以外の細菌培養同定検査において強く疑われ、日本救急医学会急性期 DIC 診断基準が4点以上の場合又はこれに準ずる場合。
-
イ.次のいずれも満たすもの。なお、診療報酬明細書の摘要欄に①及び②の要件を満たす医学的根拠について記載すること。
- ①「日本版敗血症診療ガイドライン2016」に基づき、quick SOFAで2項目以上の項目を満たし、敗血症を疑った時から臓器障害評価を行った間で、総SOFA スコアの2点以上の上昇を認めること。
- ②適切な輸液負荷にもかかわらず、平均血圧65mmHgを維持するために循環作動薬を必要とし、かつ血清乳酸値 2mmol/L (18mg/dL)を認めること。
-
-
エンドトキシン選択除去用吸着式血液浄化法において、18歳未満の患者にあっては、エンドトキシン血症であるもの又はグラム陰性菌感染症が疑われるものであって、細菌感染症を疑ってから当該治療が終了するまでの期間におけるエンドトキシン選択除去用吸着式血液浄化法の開始前の時点で、「日本版敗血症診療ガイドライン2016」における小児 SIRS 診断基準をみたすこと。
※特発性肺線維症の急性増悪に対する保険適用条件については、
特設ページ「トレミキシン 特発性肺線維症(IPF)急性増悪 適応追加に関する情報」からご確認ください。
施行方法
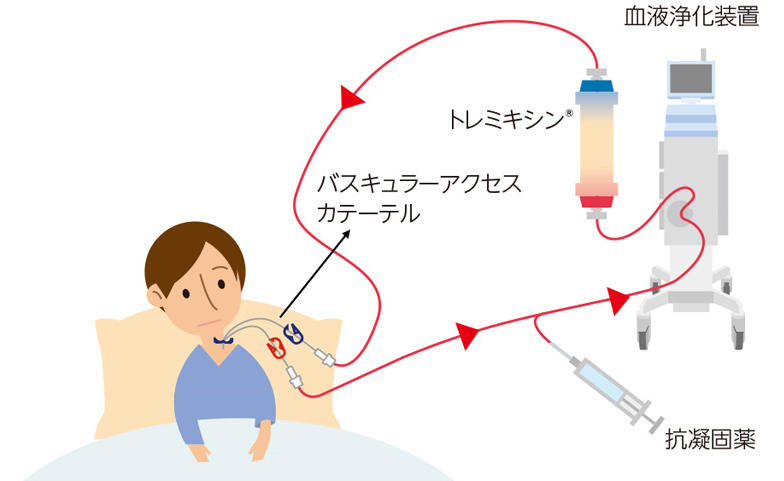
- トレミキシン®を生理食塩水等で洗浄した後、トレミキシン®・回路内をヘパリン添加生理食塩水等で満たします。
- 患者さんに応じたサイズのバスキュラーアクセスカテーテルを、大腿静脈、鎖骨下静脈、内頸静脈等に挿入します。
- カテーテル(脱血側)から血液を体外に引き出し、体外循環装置を用いてトレミキシン®に循環させて、血液をカテーテル(返血側)に戻します。血液凝固を防ぐため、抗凝固薬を投与します。
- 治療終了後は、生理食塩水等を低流量で流して、トレミキシン®・回路内の血液を患者さんに戻します。
| 洗浄量 | PMX-20R:4L以上 PMX-05R:2L以上 PMX-01R:0.5L以上 |
|---|---|
| 血液流量 | PMX-20R:80~120mL/分 PMX-05R:20~40mL/分 PMX-01R:8~12mL/分 |
| 施行時間 | 原則2時間 |
| 抗凝固薬 |
例)ナファモスタットメシレート 持続注入30~40mg/時
|

電子添文
使用上の注意
【警告】
-
使用方法
1)本品の使用中は、患者について常に十分な観察を行うこと。
[本品の使用により、血小板減少、血圧低下、及びアレルギーがあらわれることがある]2)本品を既存治療が奏効しない特発性肺線維症の急性増悪の治療へ用いる場合は、関連学会の定める基準を満たす施設・術者により使用すること。
また、適正使用基準に基づく症例選択等を遵守して使用すること。
【禁忌・禁止】
-
使用方法
再使用禁止。
【使用上の注意】
-
使用注意(次の患者には慎重に適用すること)
腎機能が低下している患者 [4L (PMX-20Rの場合)、2L (PMX-05Rの場合)または0.5L (PMX-01Rの場合) の生理食塩液等による洗浄後にもカラム内に極微量(1 ppb以下)のポリミキシンBが溶存する可能性は完全には否定できないため]。
-
重要な基本的注意
- 治療中は、患者体温の低下に注意し、必要に応じ回路・身体等の適切な加温を行うこと。
- 本品はプラスチック製品なので、運搬、操作に際し慎重に取り扱うこと。
-
相互作用(他の医薬品・医療機器等との併用に関すること)
-
併用注意(併用に注意すること)
本品に固定されているポリミキシンBは、薬剤として経口投与、局所投与された場合の相互作用、副作用として、以下の症状が使用上の注意に記載されている。
-
①
相互作用
麻酔剤、筋弛緩剤、アミノグリコシド系抗生物質と併用した場合は、相互作用としてクラーレ様作用(神経筋遮断作用)による呼吸抑制があらわれることがあるため、併用に注意すること。
-
②
副作用
重大な副作用:ショック、難聴、神経筋遮断作用による呼吸抑制
その他の副作用:腎障害、知覚異常、眩暈、頭痛、発熱、嗜眠、運動失調、視覚障害、発疹、瘙痒感、悪心・嘔吐、食欲不振、下痢、蟻走感、舌・口唇部のしびれ感
-
-
-
不具合・有害事象
-
重大な不具合・有害事象
-
①
重大な有害事象
本品の使用中に、患者の病態等により以下の重大な有害事象があらわれることがある。使用中の患者の状態には十分注意を払って使用すること。異常が認められた場合には直ちに適切な処置を行うこと。
重大な有害事象: 血小板減少、血圧低下、アレルギー(紅斑等の症状)、ショック(血圧低下、呼吸困難、頻脈、体温低下、胸痛、嘔吐、チアノーゼ等の症状)、アナフィラキシー・ショック、心室性頻脈、心室細動、脳梗塞
-
②
その他の不具合・有害事象
以下のような不具合・有害事象があらわれることがあるので、観察を十分に行い、適切な処置を行うこと。
その他の不具合・有害事象:
不具合:抗凝固薬の投与条件、患者の病態等に起因する血液浄化器入り口での圧上昇。抗凝固薬の投与条件、患者の病態等に起因する血液浄化器内での凝血。
有害事象:低酸素血症、心悸亢進、出血
-
-

